新版醫療器械管理體系標準ISO 13485應對指南

朱丹

德國萊因TÜV大中華區醫療器械服務部專案經理 | 在醫療器械研發、品質管制和認證領域擁有15年以上的豐富經歷,作為審核員多次代表德國萊因TÜV接受並通過中國、德國、加拿大、日本、巴西等國監管部門的目擊審核。
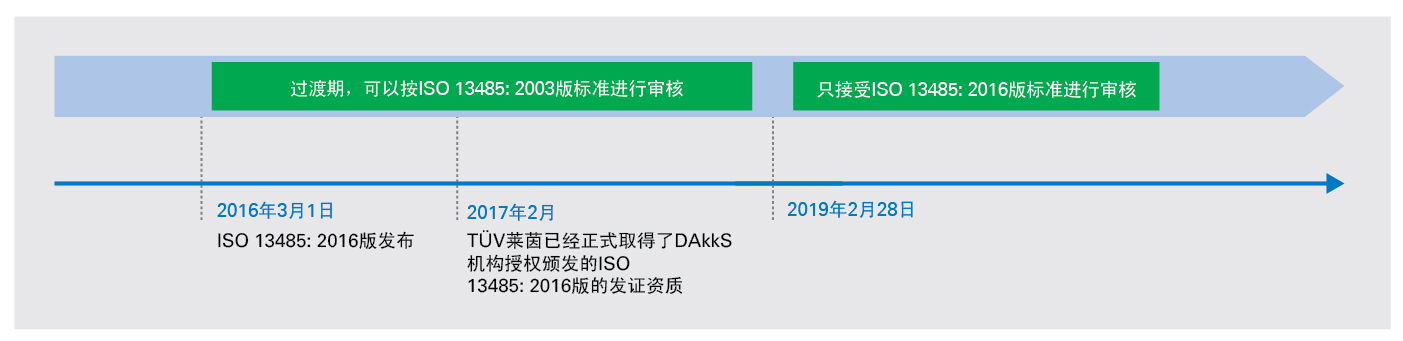
醫療器械管理系統新版標準ISO 13485:2016已於2016年3月1日正式發佈,新舊標準的過渡期將持續到2019年2月28日。為了讓更多企業及時瞭解新版本的關鍵點,德國萊因TÜV為大家詳述各關鍵時間點、新舊版本的顯著變化,並提供應對指南,協助企業順利轉版。
新版本的顯著變化一覽
1、 導入生命週期的概念。
2、 更明確定義標準的適用範圍,增加適用於醫療器械全生命週期各階段(研發、生產、上市後活動)的醫療器械組織。
3、 增加適用於供方或其他服務供方等要求。
4、 增加至20個定義,並細化一些現有定義。如:授權代表、臨床評價、抱怨、經銷商、進口商、生命週期、製造商、醫療器械族、性能評價、上市後監督、採購產品、風險、風險管理、無菌屏障系統等專業術語。
5、 增加「法規要求」術語的次數,一旦使用術語「法規要求」時,其涵蓋了適用於本標準用戶的任何法律法規的要求。
6、 強化企業滿足法規要求的主體責任。
7、 強化風險管理,不僅對醫療器械產品和服務的全生命週期實施風險管理,而且明確提出對品質管制系統的過程實施風險管理的要求,提出「應用基於風險的方法控制品質管制系統所需的適當過程」。
8、 新增「組織應將用於品質管制系統的電腦軟體應用進行確認的要求」。
9、 提出在供方評審時應基於風險的考量
10、 新標準要求應當和供方簽訂書面品質協定,適用時,應當與供方(原料和服務)簽訂書面品質協定,規定變更告知的義務。
11、 強調如果組織發現採購的產品有任何變化,需要評估此變化所帶來的影響。
12、 提出從回饋資訊中識別改進機會,輸入到風險管理以及糾正預防措施中。
13、 提出回饋資訊應包括來自生產階段的內部回饋。
14、 新標準強調了抱怨處理的重要性。
15、 新增「8.2.3向監管機構報告」條款
16、 新標準中「形成檔」達到56處,保持記錄要求48處。新增有關文件要求的條款,如4.2.3醫療器械文件以及7.3.10設計和開發文件。
企業如何應對?德國萊因TÜV為你提供行動方案
1. 獲取一份標準正式版。
2. 新舊版本差異比對,並建立「差距分析」文件。如在審核中發現缺少「差距分析」,將被記為重大不符合項。
3. 確認並分配系統變更所需要的資源,包括人力資源 。
4. 由於新舊標準差異涉及到多個部門,德國萊因TÜV建議增加內審次數,以確保能符合ISO 13485:2016的要求。
5. 瞭解認證和過渡期的時間表。德國萊因TÜV建議您儘快與我們聯繫進行證書升級。我們將採用ISO 13485:2016標準為新客戶或者是換證客戶進行審核。
6. 制定「品質計畫」,列明需要完成的工作細項 。「品質計畫」也是認證審核中需要檢查的文件。
7. 為相關人員提供新標準的培訓,溝通「品質計畫」。如果需要協力廠商為您提供預審,德國萊因TÜV能隨時為您服務。
8. 確保您的內審涵蓋「差距分析」中所列明的所有變更部分。
9. 準備接受公告機構的升級審核。
德國萊因TÜV已於2017年2月被DAkkS認可,擁有ISO 13485:2016版的發證資質。
熱門分享